„Valódi” MIC-ek a VITEK® 2 MIC-ek?
2013-03-27
A válasz igen, és a teljesítményjellemzők mérhetők és összehasonlíthatók. Az alapvető kérdés talán az, hogy mi teszi az egyik MIC-et „igazibbá” vagy „valódibbá” mint a másik. Feltehetjük azt a kérdést is, hogy van-e olyan tudományos alap, mely révén felmérhetjük egy AST módszer „igaziságát” vagy „valódiságát”. A téma objektív megvizsgálása érdekében áttekintjük a különböző tesztmódszereket, és közelebbről szemügyre vesszük a VITEK 2 megközelítését az antimikrobiális érzékenységi teszteléshez.
Háttérként, az már ismert, hogy az agar hígításos és a tápoldat hígításos módszerek jelentik az érzékenységi tesztelés referenciaként elismert módszereit, annak ellenére, hogy a kettő nem mindig mutat egyezést. Mindkét módszer a mikroorganizmus aktivitását értelmezi egy antimikrobiális szer koncentrációsorozatában, egy előre meghatározott inkubációs idő után, ami általában 18-24 óra. MIC-nek azt a legalacsonyabb koncentrációt tekintjük, amelyik gátolja a növekedést. Azok, akik rendelkeznek tapasztalatokkal e módszerek területén, tudják, hogy a gátlás vizuális értelmezése nem mindig egyértelmű, és eltérő is lehet a vizsgálatot végző személytől függően. Ennek ellenére, ezeket a módszereket tartják etalonnak és az így kapott MIC értékeket tekintik „igazinak”.
Az agar és a tápoldat hígítás mellett egyéb módszerekről is beszélnünk kell. A korong diffúziós módszer is felhasználható egy mikroorganizmus antimikrobiális szerrel szembeni rezisztenciájának meghatározásához. Bár az eredmények inkább kvalitatívak mint kvantitatívak, ez a megközelítés széles körben elfogadott. A korong diffúziós módszer esetén az inkubálási idő hasonlít az agar és a tápoldat hígításos módszeréhez, de az értelmezés megközelítése teljesen más. Ennél a módszernél egy gátlási zónát mérnek, a mérést pedig előre meghatározott tartományokhoz történő hasonlítással értelmezik. Az értelmezési zónák meghatározásához egy sor mikroorganizmust tesztelnek, majd a megfigyelt gátlási zónákat a MIC értékekhez hasonlítják. E módszer elfogadottsága a gátlási zónák és az ismert MIC értékek korrelációján alapszik. Tegyük fel azt a kérdést, hogy e kapcsolat léte „igazivá” vagy „valódivá” teszi-e a korong diffúziós eredményeket.
Egy másik módszer, melyet át kell tekintenünk, az AB Biodisk Etest®, mely egy kvantitatívabb módszer, mint a korong diffúzió. Ez a teszt hasonló inkubációs időkkel dolgozik, mint az agar és a tápoldat hígítás. Vannak mikrobiológusok, akik szeretik azt, hogy interpolálás révén az Etest egy teljesebb skálán adja meg az eredményt, mint a standard sorozatos kétszeres hígítási értékek. Ha a mikrobiológusok elfogadják az Etest eredményeket valódinak, akkor ezt azon bizonyítékok alapján teszik, melyek szerint szoros korreláció van az Etest eredményei és a referencia módszer eredményei között. Tegyük fel ismét azt a kérdést, hogy e kapcsolat léte „igazivá” vagy „valódivá” teszi-e az Etest eredményeket.
Ha egy referencia módszerrel fennálló korreláció elegendő ahhoz, hogy a korong diffúzió és az Etest elfogadott és „valódi” legyen, akkor nem kellene-e ennek elegendőnek lennie a VITEK® 2 esetében is? Szoros korreláció áll fenn a VITEK 2 rendszer AST eredményei és a referencia módszer eredményei között. Ez teljesen egyértelmű a klinikai vizsgálatokból és számos piaci értékelésből, melyek a VITEK 2 pontosságát és reprodukálhatóságát bizonyítják a referencia módszerekhez viszonyítva. Az USA Élelmiszer- és Gyógyszerellenőrző Hivatala (FDA) és más illetékes szabályozó hatóságok jóváhagyják a VITEK 2 teszteredményeket, mert szignifikáns közvetlen kapcsolat áll fenn a VITEK 2 eredmények és a referencia módszer MIC értékei között. A szabályozó hatóságok által megvizsgált összes AST termék hasonló szintű szigorú tesztelésen megy keresztül. Ezért most vizsgáljuk meg, miért gondolják egyes mikrobiológusok azt, hogy a VITEK 2 MIC értékei nem igazi MIC-ek.
A felvetések szerint a VITEK 2 MIC értékek nem lehetnek „valódiak” két alapvető ok miatt:
1) a gyors AST eredmények általában nem lehetnek „valódiak” a lerövidített inkubálási idő miatt és
1) a gyors AST eredmények általában nem lehetnek „valódiak” a lerövidített inkubálási idő miatt és
2) csak egy teljes sorozat kétszeres hígítás eredményeképp kapott eredményt lehet „valódi” MIC eredménynek tekinteni.
Először foglalkozzunk a hagyományos 18-24 órásnál rövidebb inkubálás problémájával. A legfontosabb kérdés az, hogy szükséges-e 18-24 órás inkubálás a késői rezisztencia kimutatásához. Fontos, hogy ne feledkezzünk meg arról, hogy nem lehet olyan teszt folyamatot létrehozni, amelyik minden mikroorganizmushoz optimális lenne. A mikroorganizmus populáció sokfélesége miatt, minden AST módszernél előfordul néha téves eredmény. Az AST tesztelések megkezdése óta a 18-24 órás inkubálási idő vált elfogadottá, a pontosság miatt, melyet így a mikroorganizmusok széles körében el lehetett érni. Nincs olyan fiziológiai ok, mely arra utalna, hogy a 24 órás inkubálási idő a helyes. Megismételve, az AST módszerek számára kritikus feladat, hogy nagy arányban tudjon pontos és reprodukálható eredményeket adni, a mikroorganizmusok döntő részének tesztelésekor. Ha egy módszer, mely 18 óránál kevesebb inkubálást igényel, elfogadható teljesítményt ad a mikroorganizmusok széles körében, akkor az a módszer végül is elérte ugyanazt a célt, mint egy másik, hosszabb inkubálást igénylő módszer.
Ezután, gondoljuk át azt az elképzelést, mely szerint egy teljes sorozat kétszeres hígításra lenne szükség a „valódi” MIC érték meghatározásához. Technikailag, a MIC értékek általában nem esnek a kétszeres hígítási értékekre, sokkal inkább egy folytonos skálán helyezkednek el. Például, egy olyan mikroorganizmus esetén, amelyik növekedést mutat 8 μg/ml-es koncentrációnál és nem mutat növekedést 16 μg/ml-nél, a MIC értékét 16 μg/ml-nek tekintik. Valójában, a MIC valahol a 8 μg/ml és a 16 μg/ml között van. Ez arra kényszerít minket, hogy feltegyük a kérdést: egy olyan teszt módszer, amelyik egy kétszeres hígítási sorozat skáláján adja meg az eredményeket, tényleg „valódi” MIC értékeket ad? Az ok, amiért a MIC értékeket egy kétszeres hígítási sorozat skáláján mérik az az, hogy a referencia módszerek hagyományosan kétszeres hígításokat használnak. Referencia módszerekkel meghatározva, a MIC egyszerűen az a legkisebb megkétszerezett hígítás, amelynél már nem látható növekedés. Mivel a referencia módszerek a van növekedés/nincs növekedés megközelítést alkalmazzák, egy teljes sorozat kétszeres hígításra van szükség az értelmezéshez. Más szóval, a referencia módszerek megközelítése az, ami létrehozza a teljes sorozat kétszeres hígítástól való függést. Az antimikrobiális érzékenységi tesztelés tudománya önmagában nem írja elő ezt a feltételt.
És most vizsgáljuk meg a VITEK 2 módszer által nyújtott antimikrobiális érzékenységi tesztelést. Alapvető azt tudni, hogy a VITEK 2 rendszer folyamatosan monitorozza a mikroorganizmus aktivitását, akár 18 órán keresztül. Ennek eredményeképp, rendelkezésünkre állnak adatok annak megvizsgálásához, hogy az egyes mikroorganizmusok hogyan növekednek az antibiotikumot nem tartalmazó táptalajban (növekedési kontroll zseb) és az antibiotikum egyre növekvő koncentrációjú sorozatának jelenlétében. Ezen túlmenően, a VITEK 2 meg tudja határozni
1) egy adott mikroorganizmus lag fázisának időszakát és
2) a növekedési görbe exponenciális szakaszában a növekedés rátáját és nagyságát.
Ezeket a meghatározásokat a rendszer a növekedési kontroll zseb és az antibiotikumot tartalmazó zsebek esetében is elvégzi.
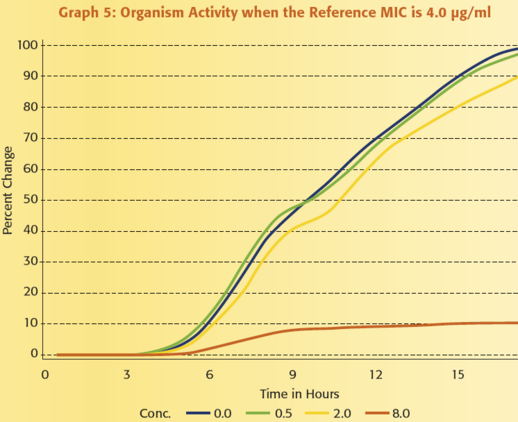
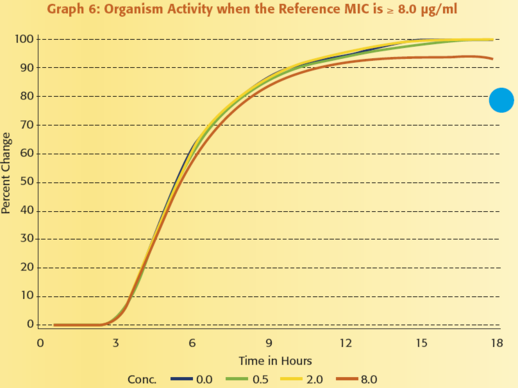
Annak illusztrálására, hogy mennyire értékes a mikroorganizmus aktivitásának folyamatos monitorozása, tegyük fel, hogy egy antimikrobiális szer MIC értékeit szeretnénk jelenteni a ≤ 0,25 μg/ml és ≥ 8 μg/ml közötti tartományban. Az 1 – 6. grafikonok mutatják be a VITEK 2 rendszer által kapott adatok és egy referencia módszerrel kapott eredmények közötti kapcsolatot. Mindegyik grafikon egy adott mikroorganizmus VITEK 2 rendszerrel megfigyelt növekedését ábrázolja amikor:
1) nincs jelen antibiotikum, kék vonal
2) az antibiotikum koncentrációja 0,5 μg/ml, zöld vonal,
3) a koncentráció 2,0 μg/ml, sárga vonal és
4) a koncentráció 8,0 μg/ml, narancssárga vonal.
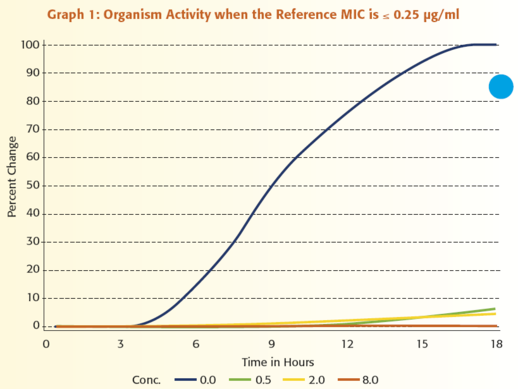
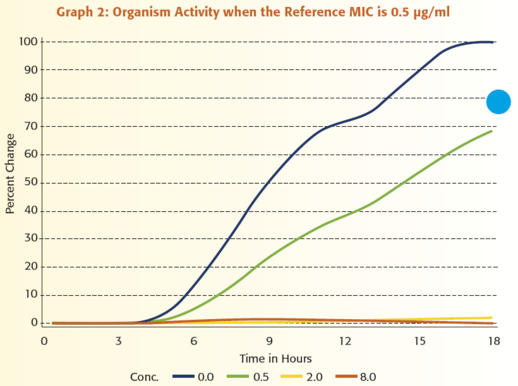
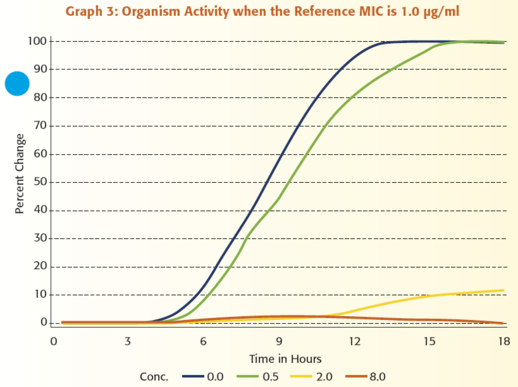
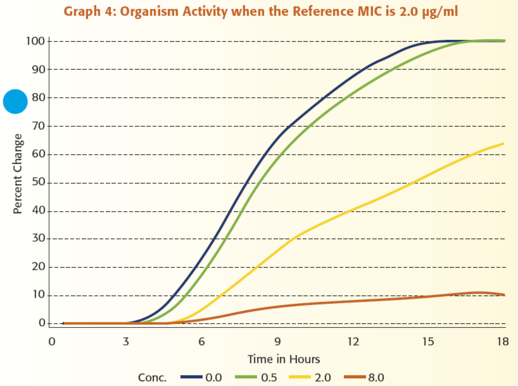




Figyeljük meg azt is, hogy a referencia MIC mindegyik grafikonon eltérő.
A grafikonok áttekintésekor az egyik legszembeötlőbb megfigyelés az, hogy a különböző antibiotikum koncentrációk mellett meglévő aktivitást hatékonyabban tudjuk értelmezni annál, hogy csak megállapítjuk, hogy van-e növekedés vagy nincs. Mindössze három koncentrációt használva, a VITEK® 2 hat egyedi növekedési mintázatot tud megkülönböztetni, ami hat különböző MIC érték jelentését teszi lehetővé. Egy másik fontos funkciója a VITEK 2 általi analízisnek az az, hogy képes a teszt mikroorganizmus adatainak standardizálására, összehasonlítva az egyes antibiotikum koncentrációknál történő növekedést a kontroll zsebben történő növekedéssel. Ez a lépés, melyet úgy nevezünk, hogy a mikroorganizmus relatív növekedésének meghatározása, alapvető fontosságú, mivel a különböző típusú mikroorganizmusoknál eltérő a növekedési görbe alakja. A lag fázis hossza, a változás meredeksége az exponenciális fázis során, és a változás nagysága az exponenciális fázisban mind hozzájárul ahhoz, hogy egy mikroorganizmus egyedi növekedési jellemzőkkel rendelkezik. Az adat standardizálási folyamat megértéséhez, szabad szemmel hasonlítsuk össze a 0,5 μg/ml-es zsebben történő növekedést a növekedési kontroll zsebben történő növekedéssel a 2. grafikonon. A növekedés a 0,5 μg/ml-es zsebben mintegy 60%-a a növekedési kontroll zsebben történő növekedésnek. Végezzen el egy hasonló szemmel történő összehasonlítást a 3. grafikonon. Ebben az esetben a mikroorganizmus aktivitása a 0,5 μg/ml-es koncentráció mellett 95%-a annak, ami a csak táptalajt tartalmazó zsebben történik. A VITEK 2 meghatározza a mikroorganizmus relatív növekedését, vagyis standardizálja az adatokat, az eldobható tesztcsíkon lévő mindegyik antibiotikum koncentrációhoz. Az 1. táblázat e folyamat eredményeit összegzi, felsorolva a mikroorganizmus relatív növekedését az 1- 6. grafikonokban lévő adatokra vonatkozóan. E táblázatot használva, láthatjuk a számszerű összefüggést a referencia módszer MIC értékei és a mikroorganizmus növekedése között, amint azt a VITEK 2 meghatározta.


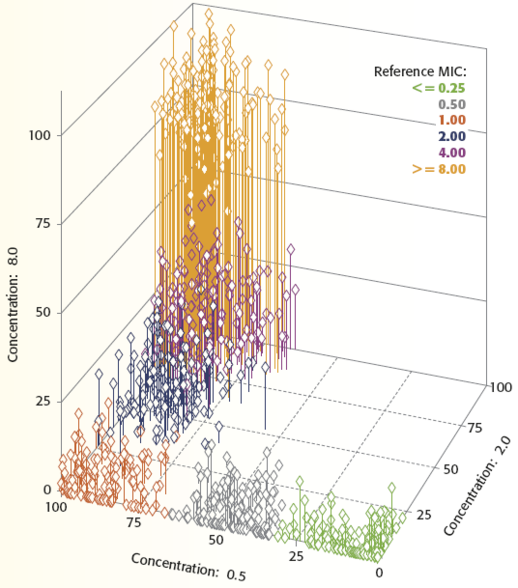
A három relatív növekedési értéket számos mikroorganizmusra vonatkozóan feltüntetve, megkapjuk az 1. ábrát. Mindegyik dimenzió az antibiotikum egy koncentrációja melletti relatív növekedést jelöli. Mindegyik rombusz a három relatív növekedési értékhez tartozó pontot jelöli egy adott mikroorganizmusra vonatkozóan. A különböző színklaszterek a ≤ 0,25 μg/ml-től a ≥ 8,0 μg/ml-ig tartó tartományba eső MIC-eket jelölik. Például, a 3. grafikonnak megfelelő adatokat reprezentáló rombusz a 90%, 8%, 2% pontnál lenne. A 90%-ot a 0,5 μg/ml-es tengelyen kellene felvenni, a 8%-ot a 2,0 μg/ml-es tengelyen, a 2%-ot pedig a 8,0 μg/ml-es tengelyen. Mivel e mikroorganizmus MIC értéke 1,0 μg/ml, a rombusz színe narancssárga lenne, az ábra jobb felső részén megadott referencia MIC kulcs alapján. Összefoglalva, a háromdimenziós ábra jól szemlélteti a VITEK 2 azon egyedülálló képességét, hogy hat különböző MIC között differenciáljon egy adott antimikrobiális szer mindössze három koncentrációját használva. Ezen túlmenően, azt is láthatjuk, hogy a relatív növekedés meghatározása hogyan teszi lehetővé a VITEK 2 rendszer számára, hogy egy mikroorganizmus egyedi növekedési jellemzőjét alkalmazza a MIC meghatározásához.

Most már láttuk, hogy hogyan segíti a mikroorganizmusok aktivitásának folyamatos monitorozása a MIC értékek meghatározását. A folyamatos monitorozás az adott mikroorganizmus esetén szükséges inkubálási idő meghatározásához is alapvető a VITEK® 2 rendszerben. Mint már korábban is említettük, a lag fázis hossza minden mikroorganizmusnál egyedi. Mivel a VITEK 2 meg tudja állapítani, hogy mikor lép át egy mikroorganizmus a lag fázisból az exponenciálisba, az elemző szoftver az adott mikroorganizmus által mutatott növekedés alapján meghatározza a megfelelő inkubációs időt. A VITEK 2 úgy van beprogramozva, hogy miután a mikroorganizmus elérte a lag fázis végét a növekedési kontroll zsebben, egy előre meghatározott ideig várakozzon, annak megfigyelésére, hogy történik-e növekedés a legalacsonyabb koncentrációjú antibiotikumban. Ha ezen intervallumon belül történik növekedés, a VITEK 2 ismét kiterjeszti az inkubálást egy előre meghatározott ideig, hogy felmérje a növekedést a többi koncentrációban. Ez a kiterjesztés addig folytatódik, amíg
1) növekedés tapasztalható a legmagasabb koncentrációban vagy
2) nem történik további szignifikáns növekedés.
E folyamatot használva, a VITEK 2 viszonylag rövid inkubációs időt tud használni nagyon érzékeny mikroorganizmusoknál. Ugyanakkor, a VITEK 2 elemzés a késői rezisztencia kimutatására is képes. Végső soron a mikroorganizmus határozza meg az inkubálási idő hosszát. A készülék csupán alkalmazkodik a detektált növekedéshez.
Összefoglalva, a VITEK 2 megközelítés az AST eredmények meghatározására vonatkozóan, valóban szakít a hagyományokkal. De ne felejtsük el, hogy a tudomány célja nem a hagyományok továbbvitele. A VITEK 2 azon képessége, hogy folyamatosan monitorozza a mikroorganizmusok aktivitását az inkubáció hosszának meghatározásához, valamint a MIC meghatározásához, az adatok hatékony és hatásos felhasználását jelenti. A klinikai vizsgálatok és a piaci értékelések során ismételten bebizonyítottuk, hogy ez a folyamat pontos és reprodukálható eredményeket ad. Ha más módszerek (pl. a korong diffúzió és az Etest®) hasonló kiértékelések révén alapozták meg azt, hogy az általuk adott MIC értékek „valódiak”, akkor hogyan lehetne a VITEK 2 eredményeket bármi másnak is tartani, mint „valódinak”?
Szerző: Michael Ullery, az AST Algoritmusok tervezője, bioMérieux, Inc.
Szerző: Michael Ullery, az AST Algoritmusok tervezője, bioMérieux, Inc.








